Ензими
определение
Ензимите са химични вещества, които могат да бъдат намерени в цялото тяло. Те задействат химическите реакции в тялото.
история
Думата ензим е направен от Вилхелм Фридрих Кюне 1878 и произлиза от гръцката измислена дума encimon, която означава мая или закваска. Тогава това намери път в международната наука. The международен съюз за чиста приложна химия (IUPAC) и международен съюз по биохимия (IUBMB) разработи номенклатура за ензимите, която определя представителите на тази голяма група вещества като обща група. Именуването, което класифицира ензимите според техните задачи, е важно за определяне на задачите на отделните ензими.
Илюстрация на ензимите
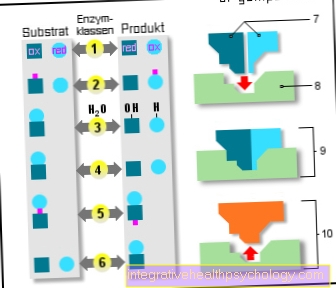
Ензими
6 ензимни класа:
- Оксидоредуктази
(Окисление / редукция) - Трансферази
(Предаване) - Хидролази
(Използване на вода) - Лиази
(Разцепване) - Изомерази
(същата емпирична формула) - Лигази
(Реакции на добавяне) - Субстрати
- Активен център
- Ензим / субстрат
комплекс - Ензим / продукт
комплекс
Преглед на всичкиизображенията на Dr-Gumpert могат да бъдат намерени на: медицински илюстрации
Именуване
The Именуване ензимът е включен три основни принципа базиран. Имената на ензимите, завършващи на –аза, описват няколко ензима в системата. Самото име на ензима описва реакцията, която ензимът задейства (катализирана). Името на ензима също е класификация на ензима. В допълнение, кодова система, която EC номер система, в който ензимите са направени под цифров код четири числа може да се намери. Първото число обозначава ензимния клас. Списъците на всички открити ензими гарантират, че посоченият ензимен код може да бъде намерен по-бързо. Въпреки че кодовете се основават на свойствата на реакцията, която ензимът катализира, на практика цифровите кодове се оказват тежки. Систематичните имена, базирани на горните правила, се използват по-често. Проблеми с номенклатурата възникват например при ензими, които катализират няколко реакции. Затова понякога има няколко имена за тях. Някои ензими имат тривиални имена, които не показват, че споменатото вещество е ензим. Тъй като имената традиционно се използват широко, някои от тях са запазени.
Класификация според ензимната функция
Според IUPAC и IUBMB ензимите са разделени на шест ензимни класа според реакцията, която те задействат:
- Оксидоредуктази
Оксидоредуктазите задействат окислително-възстановителните реакции. При тази химическа реакция електроните се прехвърлят от единия реакционен партньор в другия. Едно вещество освобождава електрони (окисляване), а друго вещество приема електрони (редукция).
Формулата за катализираната реакция е A ?? + B? A? + B?.
Вещество А освобождава електрон (?) И се окислява, докато вещество В абсорбира този електрон и се редуцира. Ето защо окислително-редукционните реакции се наричат още редукционно-окислителни реакции.
Много метаболитни реакции са редокс реакции. Оксигеназите пренасят един или повече кислородни атоми към техния субстрат. - Трансферази
Трансферазите пренасят функционалната група от един субстрат в друг. Функционалните групи са атомни групи в органични съединения, които до голяма степен определят свойствата на веществото и реакционното поведение. Химичните съединения, които имат едни и същи функционални групи, са групирани в класове вещества поради сходните им свойства. Функционалните групи ще бъдат разделени според това дали са хетероатоми или не. Хетероатомите са всички атоми в органичните съединения, които не са нито въглерод, нито водород.
Например: -OH -> хидроксилна група (алкохоли) - Хидролази
Хидролазите разделят връзките в обратими реакции, използвайки вода. Естери, естери, пептиди, гликозиди, киселинни анхидриди или С-С връзки. Реакцията на равновесие е: A-B + H2O? A-H + B-OH.
Ензим, който принадлежи към групата на хидролазите, е например алфа галактозидаза. - Лиази
Лиазите, наричани още синтази, катализират разцепването на сложни продукти от прости субстрати, без да се отделя АТФ. Реакционната схема е A-B → A + B.
ATP е аденозин трифосфат и нуклеотид, състоящ се от трифосфата на нуклеозида аденозин (и като такъв богат на енергия градивен елемент на РНК на нуклеиновата киселина). ATP обаче е главно универсалната форма на незабавно достъпна енергия във всяка клетка и същевременно важен регулатор на енергийните процеси. Ако е необходимо, АТФ се ресинтезира от други енергийни запаси (креатин фосфат, гликоген, мастни киселини). АТФ молекулата се състои от аденинов остатък, захарната рибоза и три фосфати (? До?) В естер (?) Или анхидридни връзки (? И?). - Изомерази
Изомеразите ускоряват химичното преобразуване на изомерите. Изомеризмът е появата на две или повече химични съединения с абсолютно еднакви атоми (една и съща емпирична формула) и молекулни тегла, които обаче се различават по връзката или пространственото разположение на атомите. Съответните съединения се наричат изомери.
Тези изомери се различават по своите химични и / или физични, а често и по своите биохимични свойства. Изомеризмът се среща предимно с органични съединения, но също и с (неорганични) координационни съединения. Изомерията е разделена на различни области. - Лигази
Лигазите катализират образуването на вещества, които са химически по-сложни от използваните субстрати, но за разлика от лиазите са ензимно ефективни само при разцепване на АТФ. Следователно образуването на тези вещества изисква енергия, която се получава чрез разделяне на АТФ.
Някои ензими са в състояние да катализират няколко, понякога много различни реакции. Ако случаят е такъв, те се разпределят в няколко ензимни класа.
Може да се интересувате и от тези статии:
- Алфа-глюкозидаза
- Липаза
- Трипсин
Класификация според ензимната структура
Почти всички ензими са протеини и могат да бъдат класифицирани въз основа на дължината на протеиновата верига:
- Мономери
Ензими, които се състоят само от една протеинова верига - Олигомери
Ензими, които се състоят от няколко протеинови вериги (мономери) - Мулти-ензимни вериги
Няколко агрегирани ензими, които си сътрудничат и се регулират помежду си. Тези ензимни вериги катализират последователните стъпки в метаболизма на клетката.
Освен това има отделни протеинови вериги, които съдържат няколко ензимни активности; те се наричат многофункционални ензими.
Класификация според кофактори
Друга класификация е класификацията според съображенията на кофакторите. Кофактори, коензими и ко-субстрати са наименования за различни класификации на вещества, които влияят върху биохимичните реакции чрез взаимодействието им с ензимите.
Разглеждат се органични молекули и йони (предимно метални йони).
Чистите протеинови ензими се състоят изключително от протеини, а активният център се формира само от аминокиселинни остатъци и пептиден скелет. Аминокиселините са клас органични съединения с поне една карбокси група (-COOH) и една амино група (-NH2).
Холоензимите се състоят от протеинов компонент, апоензим, и кофактор, молекула с ниско молекулно тегло (не белтък). И двете заедно са важни за функцията на ензима.
Коензими
Органичните молекули като кофактори се наричат коензими. Ако те са ковалентно свързани с апоензима, те се наричат протетични групи или ко-субстрати. Протетична група се отнася до непротеинови компоненти, здраво (най-вече ковалентно), свързани с протеин с каталитичен ефект.
Косубстратите са имена за различни класификации на вещества, които влияят на биохимичните реакции чрез взаимодействието им с ензимите. Като биокатализатори, молекулите ускоряват реакциите в организмите, ензимите ускоряват биохимичните реакции. Те намаляват енергията на активиране, която трябва да бъде преодоляна, за да може веществото да се преобразува.